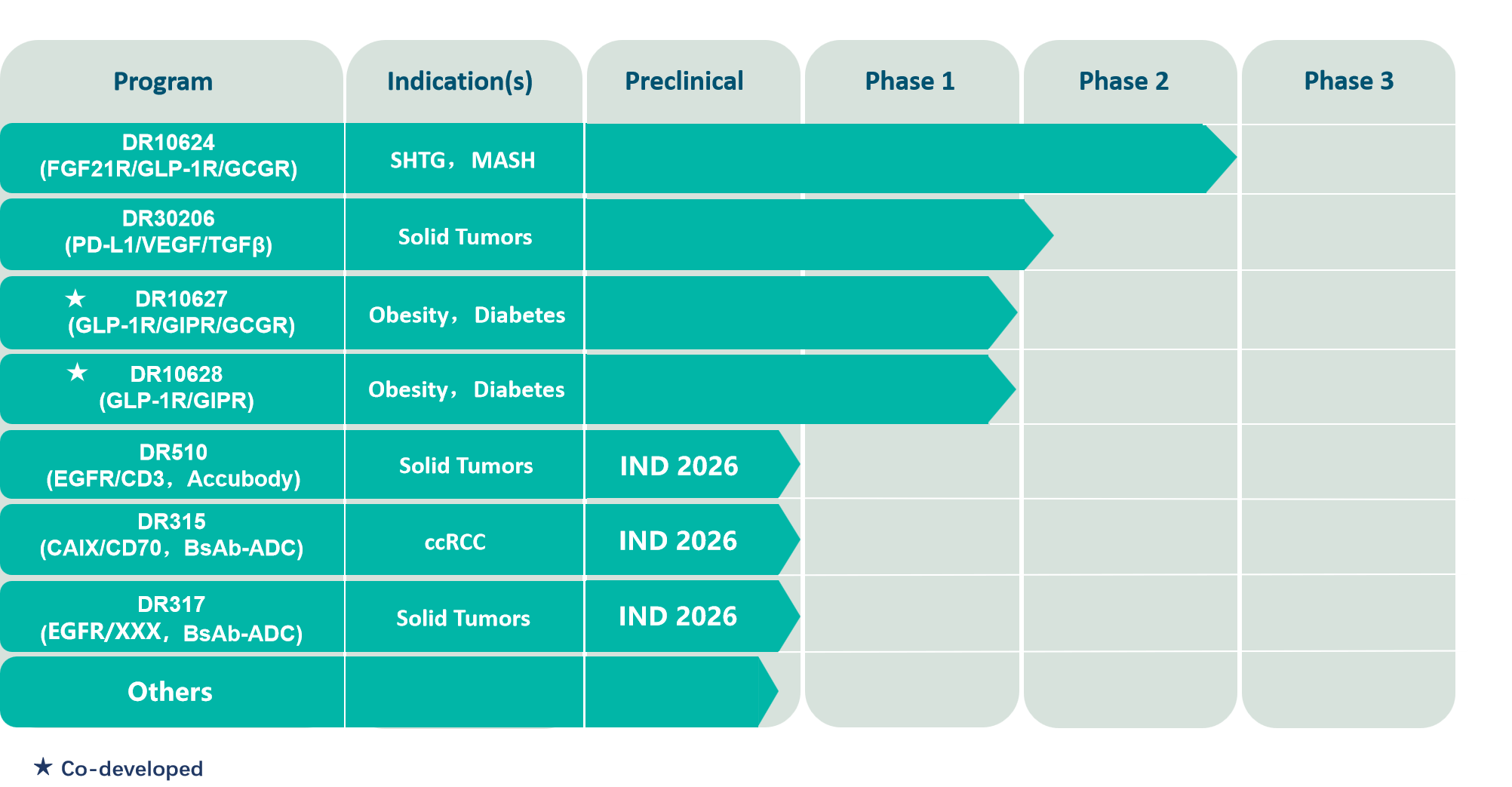
DR10624采用MultipleBody®技术平台设计,是将高稳定性的FGF21类似物、GCGR/GLP-1R双效激动多肽与人源IgG Fc组合获得的三特异性融合蛋白。DR10624于2022年4月份获得新西兰药品和医疗器械安全管理局(Medsafe)与新西兰健康及残疾伦理委员会(HDEC)批准在当地开展 I 期临床试验。DR10624在中国的临床试验于2023年7月获批,目前已完成Ⅱ期临床研究,其研究结果已在2025 AHA以大会开题报告予以公布。临床结果显示,DR10624可显著且迅速地降低甘油三酯(TG)。重度高甘油三酯血症(SHTG)患者在首次给药DR10624后即可观察到TG的快速下降,且在整个12周的治疗期内都维持较低的水平。此外,DR10624也展现出极佳的改善致动脉粥样硬化的血脂谱的药效及脂联素水平的显著提升(提示对受试者的胰岛素敏感性有极大的改善)、尿酸水平的显著降低(对肾脏、心脏等器官都有益),以及降体重的药效。DR10624安全性良好,这些积极的临床数据支持DR10624在未来开展更多大规模的Ⅲ期临床试验,进一步探索其在SHTG、混合型高脂血症、及代谢功能障碍相关脂肪性肝炎(MASH)等患者群体中的治疗潜力。
DR30206是一种靶向PD-L1、VEGF和TGF-β的三特异性融合蛋白,通过阻断 PD-1/PD-L1信号通路,中和结合游离VEGF和TGF-β,以恢复耗竭性T细胞的增殖、减少肿瘤新生血管的形成以及解除肿瘤微环境(TME)的免疫抑制,从而达到治疗肿瘤的目的。实体瘤TME异常复杂,多种免疫抑制通路并存,DR30206的三特异性设计有望改善TME的免疫环境,提高肿瘤治疗效果。DR30206在中国的临床试验于2023年6月获批,目前有多项Ib和IIa期临床研究正在进行中。
DR10627是将GLP-1R/GIPR/GCGR三效激动多肽与脂肪酸链偶联而成。多肽部分序列经过大量筛选,以最大程度优化对三个靶点的激动。在临床前动物试验中,DR10627呈现极其显著的降糖和减重药效。适应症为肥胖和糖尿病。DR10627在中国的临床试验于2022年1月获批,目前已完成I期临床研究。
DR10628是将具有GLP-1R/GIPR双效激动活性的多肽与长链脂肪酸链交联而获得的产物。在临床前动物试验中,呈现极其显著的降糖和减重药效。适应症为肥胖、糖尿病和MASH等代谢疾病。DR10628在中国的临床试验于2023年4月获批,目前已完成I期临床研究。
DR510是基于道尔生物专有的Accubody®技术平台开发的prodrug类T细胞衔接器(T-cell engager,TCE),靶向人EGFR和CD3。DR510采用具有自主知识产权的可切割底物连接肽(cleavable substrate linker),以及特异性中和aCD3 scFv的VHH作为活性屏蔽结构域(VHH masking domain, VHHm)。通过单一位点的切割即可激活TCE并释放ABD-VHHm,提高治疗活性,也确保外周脱靶毒性降至最低。Accubody®平台无需为实现肿瘤抗原和CD3靶向抗体的双重屏蔽而筛选不同的屏蔽多肽,这一特点使其有别于此前报道的多数TCE类prodrug。临床前体内外实验结果表明,DR510独特的双重屏蔽设计在疗效与安全性之间取得了关键的平衡。计划2026年递交IND,用于治疗 EGFR 阳性的实体瘤。
DR315是一款针对CA9/CD70靶点的双抗ADC,利用CA9和CD70在正常组织上表达的差异降低on-target毒性,尤其是临床上CD70靶向ADC的潜在血液毒性,提高治疗窗,适应症为肾透明细胞癌。采用新型的连接子-拓扑异构酶抑制剂载荷;在临床前体内外实验中展现出优异的的肿瘤细胞杀伤和抑制活性,NHP预毒理实验表明安全性良好。计划2026年递交IND。
DR317是一种靶向EGFR/XXX的双抗ADC药物,用于多种实体瘤的治疗,尤其是三代TKI耐药的非小细胞肺癌、铂耐药的卵巢癌等。通过调节抗体亲和力,提高EGFR/XXX双阳肿瘤细胞的选择性,同时采用新型的连接子-拓扑异构酶抑制剂载荷;通过高效的旁观者效应,进一步解决肿瘤异质性问题。在临床前动物试验中显示出卓越的抑瘤效果,NHP预毒理实验表明安全性良好,计划2026年递交IND。